- Gösterim: 21097
Deriden kemiğe kadar vücudumuzda tüm dokular fonksiyonlarına göre farklılaşmış hücreler ve bu hücreler arasını dolduran matriksten(extracelluar matrix-ECM) oluşmaktadır. Dokuda hücreler birbiri ile direkt yada ECM ile dolaylı olarak bağlanarak bir arada durmakta.
Hücreler arası boşlukları dolduran ve hücreleri bir arada tutan ECM temelde hücrelerin besin ve madde alışverişini sağlamakta. Bunun dışında dokuda hücrelerin yapısı ve hareketini, gelişimlerini, hücerenin canlı kalmasını ve farklılaşmalarını da sağlamakta.
ECM içinde bulunduğu doku hücreleri yada farklılaşmış hüreler tarafından salgılanır.Örneğin derimizde ECM bağ dokusu hücreleri olan fibroblastlar, kıkırdakta kondrobast, kemikte ise osteblastla tarafından yapılmakta. Beyin ve beyin sapında ECM az miktarda iken kemikte çok fazladır. Kemikte kalsifiye olduğu için opak iken gözde korneada şeffaftır.
ECM yapısındaki moleküller;
- Glikozaminoglikanlar(GAG)
- Hiyalüronik asit
- Kondrotin sülfat
- Dermatan sülfat
- Heparan sülfat
- Keratan sülfat gibi
- Fibroz proteinler(yapısal proteinler)
- Kolajen
- Elastin
- Fibronektin
- Laminin
- İntegrin şeklinde sınıflandırılabilir.
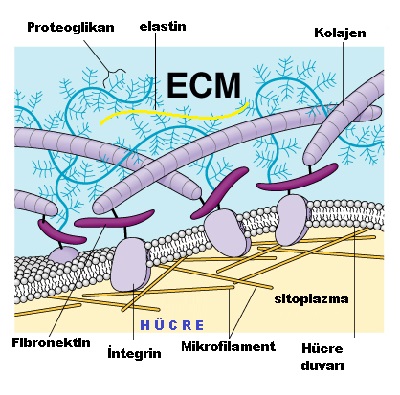
Bunların hepsinin dokuda görevleri farklıdır. Örneğin GAG lar jelimsi yapıları ile dokunun baskı gücüne karşı dayanıklılığını sağlarken, kolejen gerilme gücü vermekte, elastin esnelik katmakta, fibronektin ve laminin hücrelerin ECM nin uygun yerlerine tutunmasını sağlamakta.
Kolajenler
Kolajen kelimesi Yunanca "kola" ve "gen" kelimelerinden üretilmiştir. Yapışkandan üretilmiş anlamına gelmektedir. Kolejen dokular ve organlarda ECM' nin en önemli fibriller yapısını oluşturmakta. Protein yapısında olan kolajen memelilerin vücut protein içeriğinin % 25-30 gibi çok önemli bir bölümünü oluşturmakta. Vücudumuzda nerede ise tüm doku-organlarda kolajen bulunmakta(kemik, deri hatta gözde korneya kadar).
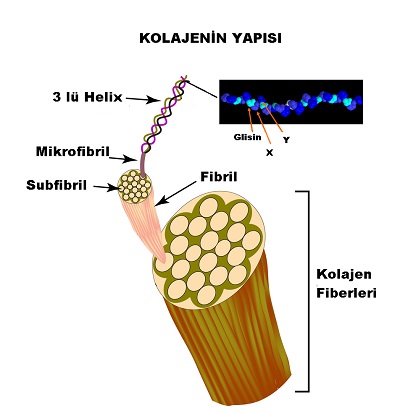
Protein yapısında olan kolajen, tekrarlayan amino asit zincirlerinden oluşmakta. 50 nin üzerinde(her geçen gün yenisi eklenmekte) biyokimyasal yapısı farklı kolajen "kolajen ailesini" oluşturmakta.
Kolajen ailesinde protein zincirinin temel yapısı; Glisin-X-Y-Glisin-X-Y-Glisin-X-Y.....şeklinde Glisin-X-Y 3 lü amino asit tekrarından oluşmakta. Protein zincirleri-polipetidler bir araya gelerek 3 lü sarmal yapılar oluşturmakta ve bunlar mikrofibril olarak tanımlanmakta. Kolajen tipine göre zincirdeki amino asit sayısı, 3 lü sarmal yapının uzunluğu, çapı ve moleküler ağırlığa değişmektedir. Gly-X-Y tekrarında glisin dışında en sıklıkla proline ve hidroksiprolini görmekteyiz.
Kolajenin ailesinin sahip olduğu çeşitlilik amino asit zincirinde X ve Y nin yerine geçen aminoasitler ile belirlenmekte ve kollajene ECM de farkı bir fiziksel ve fonksiyon sağlamakta. Kolajenin yapısal özellikleri, dokularda sentezi ve fonksiyonları, embriyonal gelişimdeki rolü anlaşıldıkça bazı hastalıkların tanımı daha rahat yapılmaya başlandı(Kondrodisplazi, osteogenezis imperfekta, Alport sendromu, Ehler Danlos sedromu, Epidermolizis bulloza). Bununla birlikte kollajenin yapım ve yıkım metabolizmasındaki bilgiler artık osteoartritis ve osteoporoz gibi hastalıkları daha iyi anlamamızı sağladı.
Kolajen altıgen yada dörtgenler şeklinde kendi üzerlerine katlanarak mikro fibriller kolajeni oluşturmakta.
Kolajenin ailesindeki zenginlik kolajenin yapısı ve moleküler organizasyonunun farklılığından kaynaklanmakta. Bu nedenle aşağıdaki gibi guruplandırılmıştır.
- Fibrilller yapıda kollajenler; Tip I, II, III, V ve XI
- Dokularda basal membranın yapısına katılan kolejenler; Tip IV kolajen
- Mikrofibriller kolajenler; Tip VI kolajen
- Anchoring-bağlayıcı kolajenler; Tp VII kolajen
- Fibriller ile ilişkili kolajenler(fibril-associated collagens-FACIT); Tip IX, XII, XIV, XIX, XX ve XXI kolajen
- Networkler oluşturan kolajenler; Tip VIII ve X kolajen
- Transmembran kolajenler; Tip VII ve VIII kolajen
- Multiplexinler; Tip XV, XVI ve XVIII kolajen
Yukardaki kolajen ailesinde %90 oranında en fazla bulunanlar fibriller yapıda olan kolejenlerdir. Tip I ve V kolajen fibrilleri kemik yapısında yer alırken II ve XI kolajen eklem kırkırdağı yapısında yer almakta. Tip IV kolejen daha esnek 3 lü helix yapısı ile hücrelerin basal membranında yer almakta. Tip VI kolajen yüksek disülfid bağları ile diğer kolajenler ile çapraz bağlar yapmakta ve böylece bir network oluşmasını sağlamakta. FACIT tip IX, XII ve XIV kolajenler tek fiberlerdir ve diğer kalın kolajen fiberler ile birlikte bu kolejen fiberlerin çaplarının kontrolünü sağlamakta. Tip VIII ve X kolajen diğer kollajenler olan XIII ve XVII ile hexagonal networkler oluşturmakta.
Kolejen mikrofiberleri 3 lü helix yapı oluştururken kolajen II, III, VIII ve X de 3 mikrofiber aynı biyokimyasal yapıya sahiptir.(homotrimerler). Buna karşın tip I, IV, V, VI, IX ve XI da mikrofiberlerin biyokimyasal yapısı her ikisinde aynı yada her üçüde farklıdır(heterotrimerler).
Kolajenin öncül formu prokolajen hücre sitoplazmasında ribozomal endoplazmik retikulum/Goligi kompleksinde yapılarak hücre sitoplazmasına geçmekte. Bu fibriller kolajenin her iki ucunda değişken N ve C propeptid alanları bulunmakta. C-propeptidinin üçlü sarmal oluşumunun başlatılmasında temel bir rol oynadığı düşünülürken, N-propeptidin fibril çaplarının düzenlenmesinde rol oynadığı düşünülmektedir. Bu alanlar N ve C prokolejenaz ile ayrılmakta.
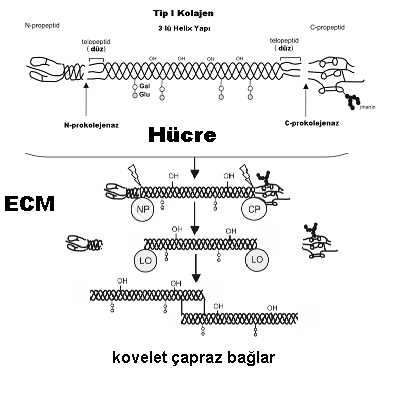
Kolajen yapısında bulunan 4-hidroksipirolin moleküller arası hidrojen bağlarını sağlarken 3 lü helix yapınında stabilitesini sağlamakta. Bu stabil kolejen yapısı pepsin, tripsin yada şimotripsin gibi enzimlere dirençlidir. Bu yapıyı bozabilecek enzim kolejenazdır. Farkılı kolejenaz enzimleri bulunmakta.
- Kolejenaz A (MMP-1); hücreler arası ECM de bulunmakta ve yara iyileşmesi gibi dokuların yeniden yapılandırılmasında rol oynamakta.
- Kolejenaz B (MMP-8) ise nötrofilerden yapılmakta ve inflamasyon sırasında doku yıkımını sağlamakta.
- Kolejenaz C (MMP-13) hipertrofik kondrositler tarafından yapılmakta kemik ile kıkırdağın yeniden yapılandırılmasında rol oynamakta. Diğer birçok matrix metalloproteinler-MMP kolajeni parçalama özeliğine sahiptir.
Derinin kolajen içeriği
Kolejen tüm dokularda olduğu gibi derinin yapısını oluşturan önemli bir yapıdır. Derinin toplam ağırlığının % 70 ini kolajen oluşturmakta. Sağlıklı, genç ve canlı bir deri yeni kolajen fiberlerine sahip olan deridir.
Deride başlıca fibroblastlar arafından sentezlenmekte.
Deride kolajen ailesine baktığımızda en yük oranda Tip I ve III kolejeni görmekteyiz. Derideki kolejen içeriğinin 80% ni Tip I kolejen iken % 15 i Tip III kolejendir. Tip I ve Tip III kolejen dermiste özelikle retiküler dermisin yapısını oluşturmakta.
Tip IV kolajen epidermis-dermis bileşkesinde epidermal basal hücrelerin üzerine yerleştiği lamina densanın yapısında bulunmakta(50 nm kalınlığında olan lamina densa).
Tip VII kolajen ise tam lamina densanın altında anchoring fibriller oluşturmakta.
Tip V kolajen hücrelerin çevresinde yer alamakta.
Derinin zengin kolajen içeriği dermisten epidermise kadar tüm yapıyı desteklerken, hücreler arası destek dokuyu-ECM oluşturan elastin ile drinin elstikiyet,ni sağlamakta ve ECM nin diğer yapıları olan proteoglikanlar ve polimerik oligosakkaridler(hyaluroni asit gibi) birlikte derinin hidrasyonunu düzenlemekte.
Kronolojik yaşlanma ve fotoyaşnam gibi gibi dış çevresel koşullar ile derid zamanla kolajen azalmakta ve içeriği değişmekte. Fibroblastlar deride yeteri kadar yeni kolajen yapamamakta. Bu değişim özellikle tip III kolejende daha belirgin ortaya çıkmakta. Tip III kolajen ileri yaşlarda özellile 20 li yaşlardan sonra hızla azalmaya başlamakta. Tip III kolejen derinin esneyebilme yeteneğinde önemlidir. Tip III deride azalırken yerine Tip I kolejen geçemekte. Tip I Tip III e göre daha rijid bir yapıya sahiptir.
Yaşlanma ile birlikte deride sadece kolajen içeriği azalmaz. Ayrıca kolajen fiberleri arasında çapraz bağlarda oluşmaya başlamakta. Bu değişim özellikle güneş kaynaklıdır(UVA). Bu çapraz bağlarda artış derinin elastikiyetinin azalmasına neden olmakta.
Deride dermisin ECM sininin major gurubunu kolajen, elastin ve protoglikanlar oluşturmakta. Bunlarda dermis fibroblastları tarafından yapılmakta. Fibroblastların aktivasyonu TGFβ ile olmakta. Fibriblastların bu aktivasyonu çoklu faktörlerle düzenlenmekle birlikte temelde üzerlerindeki mekanik gerginlikle ortaya çıkmakta. Bu gerginlik azaldığında, örneğin yaşlama ile birlikte, ECM protein yapımıda azamakta. Bu arada bu proteinlerin yıkılmasını sağlayan enzimlerde artmaktadır( kolejeni yıkan MMP-1, MMP-8 ve MMP-13 ike hyaluronik asit hyaluronidaz atarafından yıkılmakta). Elastin ise makrofajlardan yapılan MMP-12 ve MMP-3 tarafından yıkılmakta. UVA kaynaklı foto yaşlanmada bu enzimlerde artmaktadır.
Kolajen deri yüzeyine ugulandığında maalesef epidermisi geçemez. Bu nedenle kolajen ürünlerinin topikal kullanımının deri kolajen içeriği üzerine bir etkisi bulunmamaktadır.
Deride kolajen artışı fibroblastların çoğalmasının ve/veya fibroblastların yeni kolajen yapımının uyarılması ile olmaktadır. Ancak burada major problem çoğalmaya zorlanmış fibroblastların daha hızlı hücre ölümlerinin gelişmesidir. Örneğin Magnesium ascorbyl phosphate-MAP(stabil Vitamin C) deriye topikal uygulandığında fibroblastların sadece yeni kolajen yapımını uyarmakta.




