- Gösterim: 8
Parvovirüs B19; Parvoviridae ailesine mensup, küçük, zarfsız ve tek sarmallı bir DNA virüsüdür. Virüsün birincil hedefi, eritrosit prekürsörleri olan hematopoetik-eritroid hücre hattıdır. Klinik spektrumda dermatolojik bulgular ön planda olmakla birlikte, romatolojik (artropati) ve hematolojik tutulumlar da morbiditede önemli yer tutar. Romatolojik açıdan, özellikle erişkin kadınlarda romatoid artriti taklit edebilen akut simetrik poliartrit tablosuna yol açabilmektedir. Parvovirüs B19'un dermatolojik bulguları, infeksiyöz tablolardan kompleks inflamatuar süreçlere kadar geniş bir yelpazede çeşitlilik gösterir. Bu tablolar içinde en sık izleneni; çocukluk çağında 'beşinci hastalık' olarak da bilinen, hafif seyirli ve bulaşıcı bir ekzantem olan eritema enfeksiyozumdur. Diğer dermatolojik varyantlar arasında; eritema multiforme, vaskülit, retiküler eritem, makülopapüler veya püstüler döküntüler, papüler-purpurik eldiven ve çorap sendromu (PPGSS) ve Gianotti-Crosti sendromu yer almaktadır. Ayrıca, gebelik döneminde geçirilen enfeksiyonların vertikal transmisyon yoluyla fetal anemiye ve hayatı tehdit eden hidrops fetalise yol açabileceği, klinik yönetimde mutlak surette göz önünde bulundurulmalıdır.
Parvovirüsün klinik spektrumu dermatolojik, romatolojik ve hematolojik tutulumların ötesinde, nadir durumlarda hepatik ve nörolojik komplikasyonları da içerecek kadar geniştir. Dermatolojik manifestasyonlar, infeksiyöz tablolardan kompleks inflamatuar süreçlere kadar çeşitlilik gösterir. Virüsün hücreye girişi için elzem olan 'P antijeni' (globosid) reseptörü, virüsün spesifik olarak bu hücreleri hedeflemesini sağlar. Bu nedenle Parvovirüs B19’un birincil hedefi, eritroid diferansiyasyon hattında yer alan ve özellikle pronormoblast evresine yakın olan hematopoetik-eritroid hücrelerdir. Hücresel hasara karşı duyarlılık, hücre farklılaşma hattı boyunca artış göstermektedir. Virüsün eritroid hücrelere olan tropizmi, aynı zamanda endotel hücrelerinde de eksprese edilen ve virüs için hücresel reseptör görevi gören eritrosit P kan grubu antijeni (globosid) ile ilişkilidir. Parvovirüs B19 enfeksiyonunun klinik bulguları(geçici aplastik kriz veya Papüler-Purpurik Eldiven ve Çorap Sendromu [PPGSS] gibi) doğrudan viral sitopatik etkinin bir sonucu olarak değerlendirilirken; ekzantem (beşinci hastalık) ve artrit gibi diğer belirtiler, bağışıklık yanıtıyla ilişkili enfeksiyon sonrası immün-kompleks olaylarıdır(Tip III aşırı duyarlılık reaksiyonları; immün kompleksler).
Diğer viral enfeksiyonlarda olduğu gibi, humoral bağışıklık enfeksiyonun kontrolünde kritik rol oynar. Spesifik humoral yanıt, virüsün hücresel infiltrasyonunu takiben başlar. İlk olarak döküntünün ortaya çıkmasından sonraki 1-2 gün içinde spesifik IgM antikorları saptanabilir düzeye ulaşır ve yaklaşık 6-8 hafta boyunca serumda kalır. Ardından, enfeksiyonun uzun süreli kontrolünü ve kalıcı bağışıklığı sağlayan anti-parvovirüs B19 IgG antikorları tabloya dahil olur.
Parvovirüs B19 enfeksiyonları küresel bir yayılım göstermekte olup, tüm kıtalarda endemik olarak izlenmektedir; bununla birlikte belirgin mevsimsel varyasyonlar ve kalıcı enfeksiyonu olan bireylerde periyodik alevlenmeler sergilemektedir. Virüs temel olarak, asemptomatik taşıyıcıların solunum yolu salgılarında enfektif viral partiküller yayılır. Viremi fazında solunum yolu salgılarında yüksek konsantrasyonda viral DNA bulunması, en yaygın bulaş yolunun damlacık yolu olduğunu desteklemektedir. Bunun yanı sıra vertikal (transplasental) geçiş ve kan ürünleri transfüzyonu yoluyla bulaşma da dökümante edilmiştir. Virüsün primer olarak yakın temasla yayıldığı kabul edilmektedir; ev içi temaslarda bulaşma oranı çocuklarda %50, yetişkinlerde %40 iken, okul ve kreş ortamlarında bu oran %10 ile %60 arasında değişkenlik göstermektedir. Hafif bulaşıcı karakterde olan bu enfeksiyon, özellikle okul çağı çocuklarında lokalize salgınlar şeklinde ortaya çıkabilir. En yüksek insidans 6 ila 14 yaş grubu çocuklarda saptanmaktadır. Enfeksiyonun mevsimsel piki genellikle kış sonu, ilkbahar başı veya yaz başında gözlenmektedir.
Akut ve kalıcı Parvovirüs enfeksiyonlarında, klinik semptomların serum antikor düzeyleriyle korelasyon gösterdiği dökümante edilmiştir. Özellikle klasik deri döküntülerinin, yıllarca kalıcı olabilen serum IgG antikor seviyeleriyle ilişkili olduğu gözlenmiştir. Tanı, genellikle virüse karşı gelişen spesifik antikorların serolojik olarak saptanmasıyla konulmaktadır. Ancak, immün sistemi baskılanmış (HIV pozitif, transplant alıcısı vb.) hastalarda antikor yanıtı yetersiz kalabileceği için tanıda B19 DNA PCR testi kritik öneme sahiptir.
Parvovirüs B19 enfeksiyonunun en sık görülen klinik formu, her iki yanakta klasik eritemli döküntü ile karakterize olan ve halk arasında 'tokatlanmış yanak' hastalığı olarak bilinen eritema enfeksiyozumdur. Çocukluk çağı ekzantematöz hastalıklar listesinde beşinci sırada yer alması nedeniyle 'beşinci hastalık' olarak isimlendirilmiştir. Tipik ateşli viral döküntülerde olduğu gibi, klinik tablo genellikle non-spesifik bir viral prodrom (hafif ateş, halsizlik, miyalji) ile başlar; ancak bazı vakalarda prodromal dönem izlenmeksizin doğrudan cilt bulgular gelişebilir.
Eritema enfeksiyozumun klinik seyri, birbiriyle örtüşen üç karakteristik aşamada incelenir:
-
Fasiyal döküntü (Tokatlanmış yanak görünümü),
-
Gövde ve ekstremite döküntüsü (Retiküler/dantelimsi patern),
-
Rekürrens/fluktuasyon evresi (Döküntünün ısı, güneş ışığı veya egzersizle tekrarlaması).
İlk evre, yüzde parlak eritemli makülopapüler döküntülerin birleşerek hafif ödemli, simetrik ve erizipel benzeri plaklar oluşturmasıyla karakterizedir. Bu döküntünün ağız çevresini etkilememesi klinikte "perioral solukluk" olarak adlandırılır. Bu bulgu, döküntünün ayırıcı tanısında önemlidir. Literatürde tokatlanmış yanak olarak tanımlanan bu kutanöz bulgu, hastalığın en spesifik işaretidir.
İkinci aşama, gövdede makülopapüler döküntülerin belirmesiyle başlar; ardından döküntüler kalçalara ve ekstremitelere (uzuvlara) yayılım gösterir. Bu evrenin en tipik özelliği, lezyonların merkezden çevreye doğru solmasıyla oluşan ve literatürde sıklıkla 'retiküler' veya 'dantelimsi' yapı olarak tanımlanan ekzantemdir. İkinci aşamadaki retiküler döküntü, bazen Livedo Reticularis ile karışabilir. Ancak Eritema Enfeksiyozum'daki döküntünün geçici ve tetikleyicilerle değişebilir olması ayırıcı tanıda değerlidir. Döküntüler (özellikle erişkinlerde) hafif ila orta derecede kaşıntılı olabilir.
Üçüncü aşamada, döküntü karakteri nüks ve kaybolma döngüleriyle seyreden bir dalgalanma gösterir. Bu evrede döküntü tamamen kaybolmuş gibi görünse de; güneş ışığına maruz kalma, ortam sıcaklığındaki artış (ısı), fiziksel egzersiz veya duygusal stres gibi çeşitli tetikleyici faktörlere bağlı olarak daha önce etkilenen bölgelerde yeniden ortaya çıkabilir. Bu nükslerin bir re-enfeksiyon (tekrar bulaşma) ve uzun vadeli cilt veya sistemik bir sekel bırakmadığı, sadece damar genişlemesine bağlı damarsal bir yanıt olduğu bilgisi hastalara ve ailelerine verilmelidir.
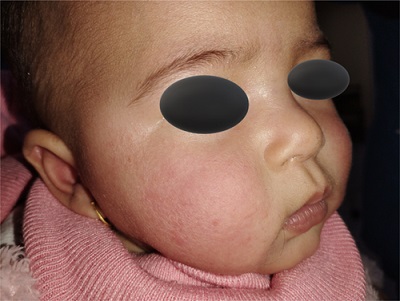
Önemli bir klinik not olarak; tokatlanmış yanak döküntüsü ortaya çıktığında, viremi dönemi sona ermiş ve antikor yanıtı başlamış demektir. Bu nedenle, döküntüsü olan çocuklar artık bulaştırıcı kabul edilmezler ve okula devam etmelerinde tıbbi bir sakınca yoktur.
Parvovirüs B19 enfeksiyonlarının diğer dermatolojik belirtileri arasında; eritema multiforme , retiküler eritem, livedo vaskülit, makülopapüler döküntüler, püstüler döküntüler, papüler-purpurik eldiven ve çorap sendromu (PPGSS) ve Gianotti-Crosti sendromu yer almaktadır. Ancak, Gianotti-Crosti sendromunun etiyolojisi Parvovirüs enfeksiyonuna özgü olmayıp, farklı viral veya bakteriyel ajanlarla da ilişkili olabilmektedir.
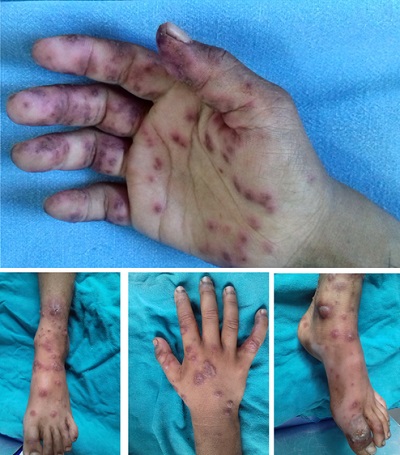
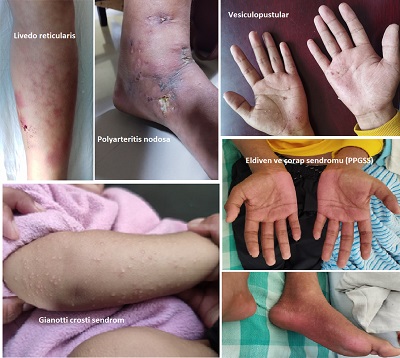
Papüler-Purpurik Eldiven ve Çorap Sendromu (PPGSS) tipik olarak ilkbahar aylarında genç erişkinlerde izlenen, akut seyirli ve kendi kendini sınırlayan bir tablodur. Bu sendrom, oldukça karakteristik deri lezyonları sergiler; el ve ayaklarda bileklerin eklemleri hizasında keskin bir sınırla sonlanan, 'eldiven ve çorap' dağılımı sergileyen, simetrik lokalize ödem ve eritem ile başlar. Süreç içerisinde bu bulgulara, milimetrik boyutlardan birleşmiş yamalara kadar değişen peteşiyal ve purpurik değişiklikler eklenir. Bu bölgelerde sıklıkla belirgin ödeme ağrı veya yanma hissi eşlik eder. Oral mukozada sert damak, dudaklar veya bukka mukozada küçük erozyonlar eşlik edebilir. PPGSS lezyonları klasik olarak yüz bölgesini tutmaz; ancak perioral bölge ve çene tutulumunun belirgin olduğu atipik vakalar için 'akro-peteşiyal sendrom' terimi önerilmiştir. Bu nedenle, ateş ve akral purpurik döküntü ile prezante olan hastalarda PPGSS, her zaman temel ayırıcı tanılar arasında değerlendirilmelidir. PPGSS döküntüsü olan hastaların viremi döneminde oldukları için halen bulaştırıcı kabul edildikleri bilgisi klinik önem taşır. Gianotti-Crosti benzeri" sunumlarla karışabildiği için ayırıcı tanıda serolojinin (IgM ve PCR) araştırılması önemlidir. PPGSS vakalarının tanısında serolojik bir paradoks mevcuttur: Döküntünün başlangıç evresinde, antiparvovirüs B19 IgG ve IgM antikorları genellikle henüz saptanabilir düzeyde değildir (seronegatif dönem). Buna karşın, hastaların serumunda ve deri biyopsi örneklerinde yüksek düzeyde Parvovirüs B19-DNA'sı saptanabilmektedir. Bu nedenle mutlaka PCR (DNA saptanması) yönteminin kullanılması gerekebilmektedir. Bu durum, PPGSS lezyonlarının döküntü sonrası gelişen bir immün yanıttan ziyade, aktif viremi döneminde ortaya çıktığını doğrulamaktadır. Güncel araştırmalar, Parvovirüs B19 tarafından kodlanan ve yapısal olmayan bir protein olan NS-1 (Non-structural protein 1) aracılığıyla vasküler hasarın doğrudan tetiklendiğini düşündürmektedir. İn vitro çalışmalar, NS-1'in enfekte hücrelerde apoptozu indükleme yeteneğine sahip olduğunu göstermektedir. Özetle; PPGSS'li hastalarda mukokutanöz lezyonlar viremi fazında gelişmekte, spesifik humoral immün yanıt ise bu süreci takiben şekillenmektedir. İmmün sistemi kompetan bireylerde enfeksiyon sıklıkla asemptomatik seyrederken; altta yatan hematolojik anomalisi olan hastalarda ciddi aplastik krizlere yol açabilmektedir.
Artropati ve eklem tutulumu, Parvovirüs B19 enfeksiyonlarının en önemli sistemik manifestasyonlardan biridir. Virüs; hem çocuklarda hem de yetişkinlerde artrit ve artraljiye yol açabilmekle birlikte, tutulumun karakteri yaş gruplarına göre belirgin farklılıklar sergiler.
Erişkin popülasyonda, özellikle kadınlarda, beşinci hastalığın klasik kutanöz bulgularından ziyade akut poliartropati tablosu primer klinik başvuru nedeni olabilir. Eklem ağrılarının temelinde, virüsün doğrudan eklem içine girmesinden ziyade, dolaşımdaki immün komplekslerin (antijen-antikor birleşmeleri) eklem sinovyasına çökmesi (Tip III aşırı duyarlılık) yattığı düşünülmektedir. Tipik olarak dizler, ayak bilekleri ve elin proksimal interfalangeal (PİF) eklemlerini etkileyen; ani başlangıçlı, bilateral ve simetrik karakterde bir poliartrit şeklinde prezante olur. Bu klinik tablo, simetrik tutulum özelliği nedeniyle sıklıkla Romatoid Artrit (RA) ile karışabilmektedir. Parvovirüs ilişkili artritin RA'dan farkı olarak kemik erozyonu yapmadığını ve genellikle 2-4 hafta içinde sekel bırakmadan düzeldiğini eklemek ayırıcı tanı için çok değerlidir. Diğer viral enfeksiyonlarda izlendiği gibi, hastaların yaklaşık %10'unda artropati, enfeksiyonun prodromal bir belirtisi olarak ortaya çıkabilir.
Buna karşın, çocukluk çağı artropatisi erişkinlerden farklı bir seyir izler. Pediatrik vakalarda tutulum genellikle dizler, el ve ayak bilekleri gibi daha büyük eklemleri hedef alır ve sıklıkla asimetrik bir patern sergiler. Parvovirüs B19 ile ilişkili bu eklem semptomları genellikle kendi kendini sınırlayan bir doğaya sahip olsa da, nadir durumlarda semptomların haftalarca, hatta aylarca sürebildiği kronikleşen vakalar bildirilmiştir.
Gebelikte Parvovirüs B19 enfeksiyonu ve fetal komplikasyonlar; Parvovirüs B19 enfeksiyonu varlığında sağlıklı bir gebelik süreci olasılığı yüksek olsa da, virüsün plasental geçişi; fetal anemi, immün olmayan hidrops fetalis (NIHF) ve spontan abortus (düşük) gibi ağır tablolara yol açabilmektedir. Nadir görülmekle birlikte, intrauterin fetal kayıp B19 enfeksiyonunun en dramatik sonuçlarından biridir. Maternal enfeksiyondan yaklaşık 2 ila 12 hafta sonra fetal etkilenmenin en yüksek risk düzeyine ulaştığı bilinmeli, takip sıklığını buna göre düzenlenmelidir. Bununla birlikte, obstetrik ultrasonografideki teknolojik ilerlemeler ve intrauterin kan transfüzyonu gibi girişimsel tedavi yöntemleri sayesinde fetal mortalite oranları önemli ölçüde azalmıştır. Günümüzde NIHF tablosunun en yaygın infeksiyöz etiyolojik ajanı Parvovirüs B19’dur.
Fetal dönemde organizma, hızla artan kırmızı kan hücresi kütlesi ihtiyacı nedeniyle yoğun bir eritropoeze bağımlıdır. B19 enfeksiyonunun eritroid öncül hücrelerini hedef alarak eritropoezi durdurması, fetüste geçici aplastik krize neden olur. Bu durum; şiddetli anemiye bağlı yüksek debili kalp yetmezliği ve miyokardit ile birleşerek immün olmayan fetal hidrops gelişimini tetikler. Fetal aneminin ultrasonografik olarak en belirgin prezentasyonu; kafa derisi ve cilt ödemi, polihidramniyos, plevral efüzyon, asit ve plasentomegali ile karakterize olan hidrops tablosudur. Bu bulgular, doğumda şiddetli anemi ve kompansatuar ekstramedüller hematopoez belirtileri (hepatosplenomegali vb.) ile klinik olarak kendini gösterir. Fetal aneminin invaziv olmayan tanısında en hassas ultrasonografik yöntem olan "Middle Cerebral Artery (MCA) Doppler" (Orta Serebral Arter tepe sistolik hızı ölçümü) dir.
Eritrosit aplazisi ve hematolojik komplikasyonlar; Parvovirüs B19 enfeksiyonu, virüsün eritroid sisteme olan yüksek tropizmi nedeniyle belirgin hematolojik anormalliklerle seyreder. Virüs, eritroid öncül hücreleri hedef alarak kırmızı kan hücresi üretiminde geçici bir duraksamaya yol açar. İmmün sistemi sağlıklı yetişkinlerde bu durum genellikle hafif ve klinik olarak önemsiz bir anemi ile sınırlı kalırken; altta yatan hematolojik hastalığı olan veya kronik kan kaybı yaşayan bireylerde tablo çok daha ağır seyredebilir. Özellikle yüksek eritropoez hızına bağımlı olan ve kronik hemolitik anemi (orak hücreli anemi, herediter sferositoz, talasemi gibi) tanısı bulunan hastalarda, B19 enfeksiyonu Geçici Aplastik Kriz (GAK) gelişimine neden olur. Bu süreçte kemik iliğindeki eritroid progenitör hücrelerin enfeksiyonu, eritropoezi durdurarak hemoglobin seviyelerinde ani ve kritik bir düşüşe yol açar. Genellikle kendiliğinden iyileşme beklense de, ağır vakalarda yüksek debili kalp yetmezliği ve mortalite riski mevcuttur. İmmün sistemi baskılanmış bireylerde (HIV pozitif hastalar, solid organ nakli alıcıları, hematolojik maligniteler) ise durum daha farklı bir seyir izler. Bu hastalarda virüsün vücuttan tam olarak uzaklaştırılamaması, persistan (kronik) saf kırmızı hücre aplazisine neden olabilir. Parvovirüs B19'un kemik iliğindeki kronik enfeksiyonu, hastanın yaşam kalitesini ciddi şekilde etkileyen ve tekrarlayan kan transfüzyonlarını zorunlu kılan dirençli bir anemi tablosuyla sonuçlanabilir. Klinik tanıda en önemli laboratuvar bulgusu retikülositopenidir (yeni kırmızı hücre üretiminin sıfırlanması). Anemisi olan bir hastada retikülosit sayısının %0 civarında olması, Parvovirüs ilişkili aplastik kriz için uyarıcı bir işarettir. Kemik iliği aspirasyonunda görülen "dev pronormoblastlar", Parvovirüs B19 enfeksiyonu için patognomonik bir sitolojik bulgudur ve tanı bölümünde vurgulanabilir. Bağışıklık sistemi baskılanmış ve kronik anemi geliştiren hastalarda, vücudun üretemediği antikorları dışarıdan sağlayan IVIG tedavisi, virüsü temizlemek ve anemiye son vermek için altın standarttır.
Laboratuvar Tanısı
Erişkin popülasyonun yaklaşık %50'si, geçirilmiş enfeksiyonlara bağlı gelişen kalıcı antikorlar sayesinde Parvovirüs B19’a karşı bağışıktır. İmmünkompetan(immun sistemi iyi olan) bireylerde semptomlar genellikle 5-7 gün içerisinde spontan olarak gerilediği için rutin laboratuvar incelemesine ihtiyaç duyulmaz. Ancak; geçici aplastik kriz, dirençli artropatiler veya gebelik sırasında maruziyet öyküsü olan hastalarda tanının doğrulanması elzemdir. Bu amaçla kullanılan temel yöntem, spesifik immünglobulin M (IgM) tespitiyle sağlanan serolojik doğrulamadır. Serolojik profil incelendiğinde; IgM ve IgG antikorları enfeksiyonu takiben kısa sürede saptanabilir düzeye ulaşır ve yaklaşık 30. günde pik titrelerine varır. IgM düzeyleri başlangıçtan sonraki 30-60 gün içinde düşüş gösterirken, IgG antikorları yaşam boyu kalıcı bağışıklığı temsil eder. ELISA, %97 gibi yüksek bir duyarlılıkla en yaygın kullanılan yöntemdir; ancak romatoid faktör varlığı veya diğer viral ajanlarla çapraz reaksiyon gelişmesi durumunda yanlış pozitif sonuçlar görülebilir. ELISA testindeki çapraz reaksiyonlar genellikle EBV (Epstein-Barr Virüsü) ve CMV (Sitomegalovirüs) ile görülür.
Serolojik Tablo;
- IgM(+) / IgG(-): Akut/yeni enfeksiyon.
- IgM(+) / IgG(+): Geçirilmiş yakın dönem (son 3 ay) enfeksiyon.
-
IgM(-) / IgG(+): Uzak geçmişte geçirilmiş enfeksiyon ve tam bağışıklık.
İmmünkompromize (bağışıklık sistemi baskılanmış) hastalarda humoral yanıt yetersiz olabileceği için serolojik testler güvenilir değildir. Bu grupta ve fetal etkilenme şüphesinde; idrar, solunum sekresyonları, doku örnekleri veya serumda viral DNA'yı doğrudan tespit eden Polimeraz Zincir Reaksiyonu (PCR) altın standarttır.
Tedavi ve Klinik Yönetim
Parvovirüs B19 enfeksiyonlarının yönetimi; tablonun klinik şiddetine, hastanın immün statüsüne ve eşlik eden komorbiditelere göre bireyselleştirilmelidir. İmmünkompetan hastalarda enfeksiyon genellikle kendi kendini sınırlayan (self-limiting) bir doğaya sahiptir ve spesifik bir antiviral tedavi gerektirmez. Tedavi yaklaşımları; asemptomatik vakalarda yakın klinik gözlemden, dirençli ve kronik enfeksiyonu olan immünkompromize konakçılarda pegile interferon alfa-2a gibi modern biyolojik ajanların kullanımına kadar geniş bir yelpazede çeşitlilik gösterir.
Parvovirüs B19'a karşı halihazırda onaylanmış bir aşı bulunmamaktadır,
Persistan (kalıcı) enfeksiyon tablosu nadir görülmekle birlikte, biyolojik tedavi uygulamaları viral yükün azaltılmasında, remisyonun sağlanmasında ve anemi gibi hematolojik parametrelerin düzeltilmesinde etkili olabilir.Ancak, bu tür ileri tedavilere rağmen tam viral klirens her zaman mümkün olmayabilir ve semptomların nüksü durumunda tedavinin tekrarı gerekebilir.
Semptomatik tedavi kapsamında; artropati gelişen hastalarda non-steroid anti-inflamatuar ilaçlar (NSAİİ) tercih edilirken, ateşli dönemlerde analjezik ve antipiretik olarak parasetamol kullanımı önerilir.
Hematolojik komplikasyonların yönetiminde ise tabloya göre stratejiler belirlenir:
-
Aplastik Kriz: Konjestif kalp yetmezliğini önlemek amacıyla eritrosit transfüzyonları hayati önem taşıyabilir.
-
Hidrops Fetalis: Şiddetli fetal anemi vakalarında intrauterin fetal kan transfüzyonları altın standarttır.
-
İmmün Yetmezlik ve Kronik Anemi: Özellikle HIV pozitif hastalar ve diğer immün yetmezliği olan bireylerde, virüse özgü antikorlar içeren intravenöz immünglobulin (IVIG) tedavisi, hem viral kontrolün sağlanmasında hem de anemi semptomlarının giderilmesinde temel terapötik alternatiftir.