- Gösterim: 68928
Sedef hastalığının nedenleri halen tam olarak açıklanamamakla birlikte, genetik geçişli olduğu ve inflamasyonun yanlış düzenlemesinden kaynaklanan bir hastalık olduğu yönünde güçlü kanıtlar bulunmaktadır.
-
Genetik Geçiş: Sedef hastalığının genetik geçişinde kromozom üzerinde PSORS I-VIII olarak tanımlanan gen lokasyonlarının sorumlu olduğu bilinmektedir. Bunların içerisinde HLA-Cw6 allel geni (PSORS I) ana majör gen lokasyonudur.
-
Tetikleyici Faktörler: Genetik yatkınlığa rağmen, hastalığın klinik tablosundan ilaçlar, fiziksel sürtünme ve travmalar, enfeksiyon ve stres gibi birçok dışsal faktörün sorumlu olduğu görülmektedir.
-
İmmünolojik Kanıtlar: Geçmişten beri sedef tedavisinde kullanılan metotreksat, siklosporin (CyA), biyolojik ajanlar ve immünotoksinlerin başarılı sonuçları, sedef hastalığının immünolojik nedenlerini desteklemektedir.
-
Bazı sitokinlerin (interferon alfa, beta, gama, interlökin (IL)-2, granülosit koloni stimüle eden faktör, bakteriyel süper antijenler) sedef kliniğini artırması bu görüşü destekler.
-
Hastalık iyileşirken lezyonlarda T lenfositlerin, dermal dendritik hücrelerin, Langerhans hücreleri, nötrofiller ve bunlar tarafından yapılan TNF-a, interferonlar ve IL-12/23'ün azalması, sedefin deri ve ekleme spesifik immün sistem kaynaklı olduğunu göstermektedir.
-
Sedef hastalığında tüm tedavi protokollerinin temeli, bu immün sistem kaynaklı inflamasyonun azaltılması üzerine kuruludur.
-
Biyolojik Ajan Tanımı: Biyolojik ajanlar, T lenfositlerini ve inflamasyondan sorumlu sitokinleri baskılayan biyolojik ilaç protokollerini kapsar.
-
TNF-a'nın Rolü: Tümör nekroz faktörü-alfa (TNF-α), psoriasis gelişiminde temel rol oynayan bir sitokindir. Günümüzde kullanılan biyolojik ajanların büyük bir bölümü bu sitokinin baskılanması üzerinedir ve anti-TNF ajanlar olarak tanımlanmaktadır.
-
Kullanım Endikasyonları: Biyolojik ajanlar; sistemik ilaçlar, fotokemoterapi gibi sistemik tedavilere cevap vermeyen, bu tedavilerin kullanılamadığı veya hasta tarafından tolere edilemediği orta ve şiddetli plak psoriasis, stabil olmayan psoriasis ve psoriatik artritli yetişkin hastaların tedavisinde kullanılırlar.
Ülkemizde, psoriasis tedavisinde kullanım için onaylı bazı aktif maddeler ve tipleri şunlardır:
-
Anti-TNF Ajanlar: Adalimumab ve İnfliksimab
-
Reseptör Blokeri: Etanersept
-
Anti-(İnterlökin-12/23) Monoklonal Antikor: Ustekinumab
Psoriasis (Sedef Hastalığı) Tedavisinde Biyolojik Ajan Kullanımı Uygunluk Ölçütleri
Biyolojik ajan tedavisi için uygunluk ölçütleri, hem uluslararası hem de ulusal düzeyde kabul görmüş tanımlara göre belirlenir. Psoriasis hastalarının biyolojik tedaviye başlaması için gereken tanımlayıcı şartlar aşağıdadır:
1. Orta-Şiddetli Psoriasis Tanımı
Hastada orta-şiddetli psoriasis var olmalıdır. Bu durum, aşağıdaki ölçütlerin sağlanmasıyla tanımlanır:
-
PASI skoru (Psoriasis Alan Şiddet İndeksi)
-
DYKİ (Dermatoloji Yaşam Kalitesi İndeksi)
-
VYA (Vücut Yüzey Alanı)
2. Özel Klinik Durumlar
Yukarıdaki şiddet ölçütlerine ek olarak, hastada aşağıdaki özel klinik durumların varlığı aranır:
-
Klinikte hızlı kötüleşme
-
Görünür alanların tutulması (yüz gibi) veya fonksiyonel yetersizliğe neden olan tutulumlar (palmoplantar, genital tutulum gibi)
-
Ağır eritrodermik veya jeneralize püstüler psoriasis
-
İş görmezliğini etkileyecek tırnak tutulumu
-
Psöriatik artrit varlığı
3. Önceki Tedavilere Yanıtsızlık veya Kontrendikasyon
Biyolojik ajanların düşünülmesi için, hastanın daha önce uygulanan sistemik tedavilere karşı yanıtının yetersiz olması veya bu tedavileri kullanamaması gerekir:
-
En az süreyle asitretin, metotreksat, siklosporin, fototerapi gibi sistemik tedavilere yanıtsız kalınması.
-
Bu tedavilerin kontrendike olduğu (kullanımına engel bir durumun olduğu) veya kullanımı sırasında yan etki geliştiği hastalar.
-
Bu tedaviler devam ederken veya tedavi bitiminden sonra içerisinde klinik tekrarların (nüks) geliştiği hastalar.
4. Yaşamı Tehdit Eden Durumlar (Tek Başına Yeterli Değil)
-
Yaşamı tehdit edecek eritrodermik veya jeneralize püstüler psoriasis varlığı tek başına biyolojik ajan kullanımına başlama ölçütü değildir, ancak hastalığın şiddetini ve aciliyetini belirtir.
Biyolojik Ajan Tedavisi Öncesi Değerlendirme
Biyolojik ajan tedavilerine başlamadan önce, hastalarda olası risk faktörlerini saptamak ve tedaviye uygunluğu belirlemek amacıyla ayrıntılı bir hastalık öyküsü (anamnez), fizik muayene, daha önce kullanılan ilaçların değerlendirilmesi ve gerekli laboratuvar tetkiklerinin yapılması zorunludur.
Detaylı Anamnez ve Değerlendirme
Tedavi öncesinde hastadan alınması gereken kritik bilgiler şunlardır:
-
Psoriasis Durumu: Psoriasisin tipi, süresi ve seyri ile psöriatik artrit varlığı detaylıca sorgulanmalıdır.
-
Önceki Tedaviler: Daha önce kullandığı tüm tedaviler (sistemik ve topikal), dozları, süreleri, etkinlikleri ve varsa yan etkileri ile ilacın kesilme nedenleri sorgulanmalıdır.
-
Eşlik Eden Hastalıklar ve İlaçlar: Varsa eşlik eden diğer kronik hastalıklar ve düzenli olarak kullandığı tüm ilaçlar kaydedilmelidir.
-
Yaşam Kalitesi: Psoriasisin hastanın yaşam kalitesine etkisi sorgulanmalıdır.
-
Antropometrik Ölçümler: Hastanın boy ve kilo ölçümleri yapılmalı, Vücut Kitle İndeksi (VKİ) hesaplanmalıdır.
-
Enfeksiyon ve Sistemik Hastalık Riski:
-
Akut ve kronik enfeksiyonlar (özellikle tüberküloz) sorgulanmalıdır.
-
Hastanın kendisinde ve derecede akrabalarında tüberküloz (TB) öyküsü, demiyelinizan hastalık ya da kanser olup olmadığı sorgulanmalıdır.
-
-
Gebelik Durumu: Kadın hastalar gebelik açısından sorgulanmalı; şüpheli olgularda gebelik testleriyle gebelik dışlandıktan sonra biyolojik tedaviye başlanmalıdır.
Bu ayrıntılı değerlendirme, hastanın tedaviye güvenli bir şekilde başlaması ve olası yan etkilerin önceden yönetilmesi için temel teşkil eder.
Biyolojik Ajanların Kullanımı Sırasında Takip
Biyolojik ajanlarla tedavi sürecinde hastaların yakından takip edilmesi, etkinliğin değerlendirilmesi ve olası yan etkilerin erken tespiti için hayati öneme sahiptir.
Takip Sıklığı
-
Hastalar, tedavinin ilk üç ayında ayda bir, sonrasında ise üç ayda bir detaylı fiziki muayene ile kontrol edilmelidir.
Tedaviye Devam Kararı ve İzlem
-
Tedaviye devam kararı, ortalama haftada değerlendirilerek verilmelidir.
-
Eğer tedaviye yeterli yanıt varsa devam edilmeli ve sonrasında üç ayda bir periyodik izlem sürdürülmelidir.
Tedavi Öncesi ve Süresince Yapılması Gereken Laboratuvar Testleri
Biyolojik tedavi öncesinde ve tedavi sırasında belli aralıklarla yapılması gereken temel laboratuvar ve görüntüleme tetkikleri şunlardır:
-
Rutin Kan Testleri: Tam Kan Sayımı
-
İdrar Testi: Tam İdrar Testi
-
Karaciğer Fonksiyonları: Karaciğer Fonksiyon Testleri
-
Enfeksiyon Taramaları:
-
Hepatit tarama testleri (Hepatit B ve C).
-
Anti-HIV testi
-
C-Reaktif Protein (CRP)
-
-
Tüberküloz (TB) Taraması:
-
Öncelikle İnterferon Gama Salınım Testi (İGST) (Quantiferon TB Gold testi) yapılmalıdır.
-
Eğer İGST yapılamıyorsa Tüberkülin Deri Testi (TDT, PPD) yapılmalıdır.
-
-
Görüntüleme: Akciğer Filmi
-
Kadın Hastalar İçin: Gebelik Testi
Bu tetkikler, tedavi sırasında da belli aralıklarla ve gerekli hallerde (klinik şüphe durumlarında) daha sık aralıklarla tekrarlanabilir.
Biyolojik Ajanların Kullanılmaması Gereken Durumlar (Kontrendikasyonlar)
Biyolojik ajanlar, immün sistemi etkilediği için bazı özel klinik durumlarda kesinlikle kullanılmamalı veya çok dikkatli bir izlem altında kullanılmalıdır.
1. Aktif Enfeksiyonlar ve Tüberküloz (TB)
-
Aktif Enfeksiyonlar: Biyolojik tedavi öncesi ve sırasında hastalar periyodik olarak sistemik veya lokal enfeksiyonlar açısından değerlendirilmelidir. Aktif enfeksiyon tespit edildiğinde tedaviye ara verilmelidir. Bu ilaçların kullanımı sırasında özellikle Salmonella ve Listeria enfeksiyonlarına karşı dikkatli olunmalıdır.
-
Aktif Tüberküloz (TB): Ülkemizde TB hala sık görüldüğü için, biyolojik ajan kullanacak hastalarda kapsamlı bir TB taraması yapılmalıdır: Anamnez, fizik muayene, akciğer filmi, PPD testi (TDT) ve spesifik interferon-gama salınım testi (İGST/Quantiferon testi).
-
Koruyucu Tedavi Gereken Durumlar: Akciğer filminde TB sekeli olması, son bir yıl içinde TB'li bir hasta ile yakın temas, TB açısından yüksek riskli sağlık personeli olunması veya İGST'nin pozitif ya da ilk TDT değerinin olması durumlarında, biyolojik tedaviye başlamadan önce koruyucu (profilaktik) TB tedavisi başlanmalıdır.
-
Koruyucu Tedavi Protokolü: Koruyucu tedavi biyolojik tedaviden bir ay önce başlamalı ve biyolojik tedavi kesilse bile boyunca İzoniazid (İNH) verilmelidir. İNH kullanılamadığında boyunca Rifampisin kullanılabilir.
-
İzlem: Biyolojik tedavi alan hastaların her bir ve tedavi kesildikten sonrasına kadar TB açısından klinik olarak izlenmesi önerilmektedir. Türkiye'de anti-TNF ve Ustekinumab kullanan hastalar için bir "Güvenlik İzlem Formu" doldurulması zorunludur.
-
2. Kanser Varlığı ve Malignite Riski
-
Mevcut Kanser: Biyolojik tedaviye başlamadan önce hastalar mutlaka malignite açısından değerlendirilmeli (dikkatli öykü ve detaylı fizik muayene). Biyolojik tedavi sırasında malignite gelişirse, tedavi derhal kesilmelidir.
-
Geçmiş Kanser Öyküsü: Tedavi öncesinde uzun kür sağlanmış solid organ tümörü ve melanom dışı deri kanseri olan olgularda biyolojik ajan kullanılabilir.
-
Yüksek Riskli Hastalar: Öncesinde PUVA, UVB almış veya iki yıldan fazla aralıksız siklosporin kullanmış hastalarda, artmış malignite riski nedeniyle daha dikkatli olunmalıdır.
3. Demiyelinizan Hastalıklar
-
Kontrendikasyon: Biyolojik ajanlar, multipl skleroz (MS) ve diğer demiyelinizasyon hastalıklarında kullanılmamalıdır.
-
Ailesel Risk: MS'li hastaların derece akrabaları da MS gelişimi için artmış riske sahip olduklarından, bu kişilerde de biyolojik ajanlar kullanılmamalıdır.
4. Konjestif Kalp Yetmezliği (KKY)
-
Kontrendikasyon: Orta ve şiddetli Konjestif Kalp Yetmezliğinde (NYKB derece 3 ve 4) anti-TNF ajanlar kontrendikedir.
-
Dikkatli Kullanım: Hafif KKY'de (NYKB derece 1-2) dikkatli kullanılmalı, ejeksiyon fraksiyonu %50'nin altında ise verilmemelidir. Yeni semptom gelişimi veya semptomların kötüleşmesi durumunda tedavi kesilmelidir.
5. Diğer Kontrendikasyonlar ve Önlemler
-
Hipersensitivite: Biyolojik ajana karşı bilinen duyarlılık (hipersensitivite) varlığı.
-
HIV/AIDS: HIV pozitif veya AIDS'li hastalar.
-
Hepatit B ve C Pozitifliği: Biyolojik tedavi öncesi tarama yapılmalıdır. Eşzamanlı Hepatit B ve Hepatit C enfeksiyonu olan hastalarda dikkatli olunmalıdır. Hepatit B enfeksiyonu varlığında, kullanım zorunlu ise viral yük tedaviden önce, sırasında ve sonrasında izlenmelidir.
-
Gebelik ve Emzirme: Gebelik kategorisi B olsa da, klinik çalışmalar yetersiz olduğu için biyolojik ajan kullanımı önerilmemektedir. Gebelik potansiyeli olan kadınlarda tedavi sırasında ve sonrasında boyunca korunma uygulanmalıdır. Gebelikte anti-TNF kullanan annelerin bebeklerinde, aşıya bağlı ciddi enfeksiyon riskine karşı canlı aşılar aydan sonraya ertelenmelidir.
-
Aşılanma: Aşılanmaya ihtiyaç duyulan hastalarda tüm aşılar biyolojik tedaviye başlamadan en az önce yapılmalıdır. Tedavi adayı hastalara öncesinde pnömokok ve influenza aşılarının yapılması önerilir. Biyolojik tedaviye başlandıktan sonra canlı aşılar uygulanmamalıdır.
6. Cerrahi ve Özel Durumlar
-
Cerrahi Müdahale: Büyük bir ameliyat veya acil cerrahi girişim durumunda biyolojik ajanlar geçici olarak kesilir, hasta normale döndükten sonra tedaviye tekrar başlanır.
-
Kronik Böbrek Yetmezliği (KBY): Yeterli veri olmamakla birlikte, zorunlu durumlarda dikkatli izlemle kullanılabileceği değerlendirilmektedir.
-
Çocuklarda ve Yaşlılarda Kullanım: Çocuk yaşta psoriasiste ülkemizde onaylı tek biyolojik ajan Etanersept'tir (Adalimumab onay aşamasındadır). Psoriasiste biyolojik tedaviler için bir üst yaş sınırı olmamakla birlikte, yaşlı hastalarda kullanımla ilgili çalışmalar henüz mevcut değildir.
Sedef hastalığı tedavisinde kullanılan biyolojik ilaçların her biri, ilacın etki mekanizmasına ve potansiyel yan etkilerine göre özel bir takip protokolü içerir. Bu protokoller ilaca göre değişse de, hastalar genel olarak belirli testlerle düzenli olarak izlenir. Biyolojik tedavi sırasında hastalardan genel olarak istenen ve tedavi boyunca tekrarlanan testler şunlardır:
-
Karaciğer Fonksiyon Testleri
-
Tam Kan Sayımı ve Trombosit Sayımı
-
Hepatit Taraması (Hepatit B ve C)
-
Tüberküloz (TB) Panel Taraması
Sedef Hastalığında Kullanılan Biyolojik İlaç Grupları
Sedef hastalığında inflamasyona neden olan immün sistem basamaklarını hedef alan biyolojik ilaçlar, etki mekanizmalarına göre üç ana grupta toplanabilir:
-
Asıl Hedefleri Patojenik T Lenfositler Üzerinden Olanlar: Bu grup, sedef patogenezinde kritik rol oynayan T hücrelerinin aktivasyonunu veya göçünü doğrudan hedef alarak inflamasyonu baskılar.
-
TNF-alfa (Tümör Nekroz Faktörü-alfa) Üzerinden Olanlar (Anti-TNF Ajanlar): TNF-alfa, sedef gelişiminde temel bir sitokindir. Bu ajanlar, TNF-alfa'yı nötralize ederek veya reseptörünü bloke ederek etki gösterir. Tedavide en sık kullanılan ilk biyolojik ajan grubudur.
-
IL-12 ve IL-23 (İnterlökin-12 ve İnterlökin-23) Üzerinden Olanlar: Bu sitokinler, Th1 ve Th17 hücrelerinin farklılaşması ve aktivasyonu için gereklidir. Bu ajanlar, özellikle IL-23 yolunu bloke ederek Th17 kaynaklı inflamasyonu azaltır.
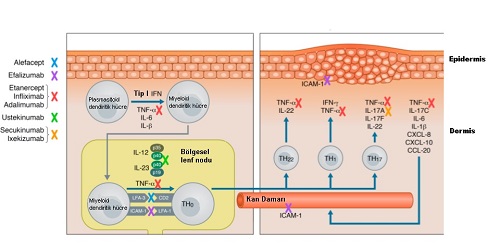
Patojenik T Lenfositleri Üzerinden Etki Eden Biyolojik İlaçlar
Sedef hastalığının patogenezinde kilit rol oynayan patojenik T lenfositleri hedef alan, ancak günümüzde kullanımdan kaldırılmış olan biyolojik ilaçlar şunlardır:
1. Alefacept
-
Etki Mekanizması: Rekombinasyon tekniği ile geliştirilmiş bir proteindir. IgG antikorlarının Fc kısımları ile T lenfositlerinin yüzeyindeki CD2 proteinlerine bağlanır. Bu bağlanma, bellek (memory) T lenfositlerinin aktivasyonunu ve dolayısıyla inflamatuvar reaksiyonu baskılamayı amaçlar.
-
Kullanım Durumu: yılında kullanımına izin verilmiş, ancak yılında piyasadan çekilmiştir.
2. Efalizumab
-
Etki Mekanizması: LFA-1'in CD11 alt ünitesine karşı hazırlanmış bir insan monoklonal antikorudur. Amacı, T lenfositlerinin diğer bağışıklık hücreleriyle etkileşimini ve dokuya göçünü engellemektir.
-
Kullanım Durumu: yılında kullanımına izin verilmiş, ancak kullanımı sırasında ciddi bir nörolojik hastalık olan progresif multifokal lökoansefalopati (PML) olgularının ortaya çıkmasından sonra yılında piyasadan çekilmiştir.
Gördüğünüz gibi, T lenfositlerini doğrudan hedefleyen bu ilk nesil biyolojik ajanlar, etkinliklerine rağmen ciddi yan etkiler nedeniyle tedaviden kaldırılmıştır. Günümüzde, TNF-alfa veya IL-12/23 gibi sitokinleri hedef alan ajanlar tercih edilmektedir.
TNF-Alfa Üzerinden Etki Gösteren Biyolojik İlaçlar
Tümör Nekroz Faktörü-alfa (TNF-α) üzerinden etki eden bu ajanlar, sedef patogenezindeki temel inflamatuvar sitokin olan TNF-a'yı hedef alarak hastalığı baskılar.
1. İnfliksimab (Infliximab)
İnfliksimab, kimerik (fare/insan) yapıda bir monoklonal antikordur ve güçlü bir TNF-α antagonistidir. TNF-α'ya yüksek oranda bağlanıp inhibe ederek inflamasyonu baskılar. Bu ilaç, TNF-α’yı bloke etmenin yanı sıra, hücre membranındaki TNF-α’ya bağlanarak onu üreten hücrelerin de ölümünü sağlar. Bu seçici etkisi nedeniyle selektif immünsüpresif ajan olarak sınıflandırılır.
İnfliksimab, geleneksel sistemik tedavilere (fototerapi dahil) yanıt vermeyen, kontrendike olan veya tolere edilemeyen orta-şiddetli psoriasis ve psoriatik artritli yetişkin hastaların tedavisinde kullanılır.
-
İlaç, Konsantre IV İnfüzyon liyofilize flakon formunda bulunur ve arasında saklanmalıdır.
-
Hasta kilosuna göre dozunda hesaplanır.
-
Uygulama Şeması: ve haftalarda ile yükleme yapılır, ardından her bir idame dozlar uygulanır.
-
İlaç, serum fizyolojik içinde hazırlanır, bir filtre sisteminden geçirilir ve üzerinde yavaş intravenöz (IV) infüzyonla verilir. Hazırlandıktan sonra en fazla içinde uygulamaya başlanmalıdır.
-
İlacın vücutta eliminasyon yarılanma zamanı 'dür.
-
Yan Etkiler: En sık görülen kesme sebebi, uygulamayı takip eden içinde görülebilen infüzyon reaksiyonlarıdır (). Reaksiyonlar genellikle veya uygulamada ortaya çıkar. Düzenli idame tedavisi alanlarda risk daha azdır.
-
Ciddi Riskler: İnfliksimab kullanımı sırasında enfeksiyon gelişme veya latent tüberkülozun (TB) aktivasyonu riski mevcuttur. Multipl Skleroz (MS) ve diğer demiyelinizasyon hastalıklarının gelişmesi veya kötüleşmesi, konjestif kalp yetmezliğinin ağırlaşması ve lenfoma/deri kanserleri gibi maligniteler nadiren görülebilir.
-
Antikor Gelişimi: Hastaların kadarında ilaca karşı nötralizan antikor gelişebilir. Yaklaşık hastada antinükleer antikorlar (ANA) gelişebilir; nadiren lupus-benzeri sendrom gelişimi tedavinin kesilmesini gerektirebilir.
-
Kombinasyonlar: Uzun dönem etkinliği korumak ve antikor gelişimini azaltmak için düşük doz metotreksat ile kombinasyonu önerilir. Ancak PUVA ile kombinasyonu deri kanseri riskini artırdığından önerilmez. Başka bir biyolojik ajanla birlikte kullanılması enfeksiyon riskini artırdığı için önerilmez.
2. Adalimumab (Adalimumab)
Adalimumab, tamamı insandan elde edilen bir monoklonal antikor ve TNF-α antagonistidir. Spesifik olarak TNF-α ile p55 ve p75 hücre-yüzey reseptör ilişkisini bloke ederek TNF-α’nın biyolojik aktivitesini baskılar.
Adalimumab, fototerapi ve geleneksel sistemik tedavilere yanıt vermeyen, kontrendike olan veya tolere edilemeyen orta ve şiddetli kronik plak tip psoriasis tedavisinde kullanılır. Avrupa İlaç Ajansı tarafından ve üzeri şiddetli kronik plak tip pediatrik psoriasis tedavisi için onaylanmıştır.
-
İlaç, kullanıma hazır enjektörler halinde bulunur.
-
Uygulama subkutan (deri altı) enjeksiyonlar şeklinde yapılır.
-
Yükleme Dozu: İlk uygulamada ve sonra ile yükleme yapılır.
-
İdame Dozu: Daha sonra düzenli aralıklarla bir subkutan enjeksiyon şeklinde devam edilir (Aşırı kilolu hastalarda da bu sabit doz geçerlidir).
-
Tedavinin etkinliği haftada değerlendirilir.
-
Palmoplantar psoriasis tedavisinde de etkilidir.
-
Yan Etkiler: En sık gözlenen yan etki enjeksiyon bölgesindeki ağrı ve eritemdir. Sık görülen diğer yan etkiler üst solunum yolu enfeksiyonları, sinüzit ve baş ağrısıdır.
-
Ciddi Riskler: Konjestif kalp yetmezliğinde kötüleşme, malignite riskinde artış ve tüberküloz reaktivasyonu çok nadir olarak bildirilmiştir. Bu ciddi yan etkiler daha çok yaşlı hastalarda görülür ve daha ciddi seyreder.
-
Kombinasyonlar: Adalimumab, ciddi enfeksiyon riskini artırdığı için diğer anti-TNF ajanlar, anakinra ve abatacept ile birlikte kullanılmamalıdır. Düşük doz metotreksat ile birlikte kullanımının etkinliği artırdığı ileri sürülmektedir.
-
Hepatit C: Hepatit C enfeksiyonu varlığında kontrendike değildir, ancak bir gastroenteroloji uzmanı eşliğinde takip ve viral yük monitorizasyonu gereklidir.
-
Pediatrik Kullanım: Çocuklarda ara ile (maksimum ) , sonrasında bir aynı dozda subkutan devamı önerilir.
Bu iki biyolojik ajan, sedef tedavisinde devrim yaratmıştır ancak potansiyel ciddi riskleri nedeniyle dikkatli bir hasta seçimi ve yakın takip gerektirir.
İnterlökinler Üzerinden Etki Gösteren Biyolojik Ajanlar
İnterlökinleri (IL) hedef alan bu ajanlar, sedef hastalığının patogenezinde T hücrelerinden sonraki kilit sitokinleri bloke ederek inflamasyonu durdurur.
1. Ustekinumab
Ustekinumab, tamamen insandan elde edilen bir IgG antikorudur. İnterlökin-12 (IL-12) ve İnterlökin-23 (IL-23) sitokinlerinin ortak alt birimi olan p40 alt birimine yüksek spesifisite ile bağlanarak her iki sitokinin de biyolojik aktivitesini baskılar. Bu baskılama sonucunda, Th1 ve Th17 hücrelerinden salınan TNF-alfa, interferon-gama, IL-17 ve IL-22 gibi diğer inflamatuvar sitokinlerin salınımı da engellenmiş olur.
-
Ustekinumab, ülkemizde yılından itibaren orta-şiddetli psoriasis ve psoriatik artrit tedavisinde onaylıdır.
-
Onay Yaşı: ve üzeri erişkin psoriasis tedavisi için onay almıştır.
-
Form: STELARA ve SC kullanıma hazır enjektör formları mevcuttur.
-
Doz: Kronik plak psoriasiste standart doz 'dır; üzeri hastalar için dozunda kullanılır.
-
Uygulama Şeması: Subkutan (SC) enjeksiyon yoluyla uygulanır. ve haftalarda birer enjeksiyon yapılır, sonrasında idame dozu bir uygulanır.
-
Avantajı: bir uygulama sıklığı, hastalar için büyük bir avantajdır (İlk yıl , sonraki yıllarda yılda ).
-
Sık Görülen Yan Etkiler: Üst solunum yolu enfeksiyonları, nazofarenjit, artralji, öksürük ve baş ağrısıdır.
-
Nadir Görülenler: Enjeksiyon yeri reaksiyonları () ve nötralizan antikor gelişimi () gözlenir.
-
Ciddi Riskler: Ustekinumab, anti-TNF ajanlarla benzer şekilde enfeksiyon ve latent enfeksiyon reaktivasyonu riskini artırır. Malignite ve nonmelanom deri kanseri gelişimi, genel popülasyonda beklenene yakındır. Majör kardiyovasküler olaylarda (MACE) genel psoriatik popülasyona kıyasla belirgin bir artış gözlenmemiştir.
-
Kombinasyon: Ustekinumab'ın kombinasyon tedavisi için kontrollü çalışması yoktur. Topikal ajanlarla kombine edilebilir.
2. Sekukinumab (Secukinumab)
Sekukinumab, İnterlökin-17A'ya (IL-17A) selektif olarak bağlanan ve onu nötralize eden, insan monoklonal antikorudur. IL-17A'yı hedef alarak, keratinositler dahil çeşitli hücre tiplerinde salgılanan IL-17 reseptörü ile etkileşimini inhibe eder ve bu sayede inflamatuvar yanıtı engeller.
-
Endikasyon: Geleneksel sistemik tedavilere yanıt vermeyen veya bu tedavilerin kontrendike olduğu orta ve şiddetli kronik plak tip psoriasis tedavisi için endikedir. Psoriatik artrit ve ankilozan spondilitte de kullanılır.
-
Form: Ülkemizde SC enjeksiyon için liyofilize toz içeren flakon (VERXANT) olarak kullanılır.
-
Dozaj Şeması: Önerilen doz sekukinumab olup, ve haftalarda yapılır. Bunu takiben bir (aylık) idame dozu şeklinde uygulanır. Her doz, 'lık iki subkutan enjeksiyon halinde verilir.
-
Tedavi Yanıtı: kadarki sürede yanıt vermeyen hastalarda tedavinin kesilmesi düşünülmelidir.
-
Sık Görülen Yan Etkiler: En sık bildirilen yan etkiler üst solunum yolu enfeksiyonu (ÜSYE), nazofarenjit ve rinit olmuştur. Diyare ve herpes labialis de yaygın görülen diğer yan etkilerdir.
-
Ciddi Riskler: Ciddi enfeksiyonlar nadiren () görülmüştür. Nötropeni plaseboya kıyasla daha sık gözlenmiş, ancak çoğu hafif, geçici ve geri dönüşümlü olmuştur.
-
Gastrointestinal Risk: Aktif Crohn hastalığı olan hastalara sekukinumab reçete edilirken dikkatli olunmalıdır, zira klinik çalışmalarda Crohn hastalığında şiddetlenmeler gözlenmiştir.
-
Aşılar: Canlı aşılar, sekukinumab ile eşzamanlı uygulanmamalıdır. İnaktive veya canlı olmayan aşılar ise uygulanabilir.
-
Kombinasyon: Psoriatrik artrit ve ankilozan spondilitli hastalarda metotreksat ve/veya kortikosteroidler ile eş zamanlı kullanımında herhangi bir etkileşim saptanmamıştır.
Diğer İnterlökin Hedefli Ajanlar
-
Sekukinumab Benzeri Ajanlar (IL-17A İnhibitörleri): İxekizumab ve Brodalumab. (Ülkemizde henüz kullanımda değildir.)
-
Faz Çalışmaları Devam Eden Ajanlar: Tildrakizumab, Risankizumab, Guselkumab. (Bunlar IL-23'ü hedefleyen yeni nesil ajanlardır.)
Biyolojik Ajanların Biyobenzerleri: Tartışmalı Konular ve Güvenlik Endişeleri
Biyobenzer ilaçlar, orijinal (referans) biyolojik ilacın özdeşi değildir. Bu durum, etkinlik, güvenlik ve takip mekanizmaları açısından ciddi tartışmaları beraberinde getirmektedir.
1. Özdeş Olmama ve Risk Yönetimi
-
Farklı Profil: Biyobenzer ürünler, referans ürünle aynı aktif maddeyi içermekle birlikte, üretim süreçlerinin karmaşıklığı nedeniyle protein sekansı, katlanma şekli, glikolizasyon paterni, fonksiyon ve immünojenisite açısından farklılık gösterir. Bu nedenle, farklı etki, yan etki ve güvenlik profillerine sahip olmaları kaçınılmazdır.
-
Hatalı Kabul Riski: Özdeş olmayan iki ilacın aynı ismi taşıması, bunların hatalı bir şekilde aynı kabul edilmesine ve otomatik olarak değiştirilebilmesine yol açabilir. Bu durum, birinde ortaya çıkacak yan etkinin haksız yere diğer ilaca mal edilmesine ve doğru takibin engellenmesine neden olur.
2. İsimlendirme ve Takip Edilebilirlik (Traceability)
-
Özgün Kimlik Gerekliliği: Dünya Sağlık Örgütü (DSÖ), biyobenzerlerin takip edilebilir olması için özgün kimliklere sahip olmaları gerektiğini vurgulamaktadır.
-
İstenen Bilgiler: Yan etki takibinde, biyoteknolojik ilacın uluslararası patentsiz ismine (INN) ek olarak; marka adı, üretici firmanın ismi, lot numarası ve üretildiği ülkenin bilgilerinin de sağlanması istenmektedir.
-
Prospektüs Farklılıkları: Referans ve biyobenzer ürünlerin prospektüslerinde; ürüne özgü güvenlik, pozoloji, kontrendikasyonlar, uyarılar ve yan etkilerin ayrı ayrı belirtilmesi beklenmektedir.
3. Değiştirilebilme ve Yerine Kullanılabilme Tartışması
Kimyasal (jenerik) ilaçlarda yaygın olan değiştirilebilme ve yerine kullanılabilme durumları, biyolojik ürünler için daha kısıtlıdır:
-
Değiştirilebilme: Tedavi devam ederken, hekimin inisiyatifi ile eşdeğer başka bir ilaca geçilebilmesidir.
-
Yerine Kullanılabilme: Hekimin onayı gerekmeden, aynı INN'ye sahip ilaçların eczane veya hastanede birbirinin yerine verilebilmesidir.
-
Avrupa Görüşü: Avrupa İlaç Ajansı (EMA) ve çeşitli Avrupa otoriteleri, biyoteknolojik ilaçların yalnızca hekimin onayı ile değiştirilebilir olabileceğine, ancak hekimin insiyatifi dışında yerine kullanılamayacağına karar vermiştir.
4. Neden Birbirinin Yerine Kullanılmamalı?
-
Antikor Gelişim Riski: Bir biyolojik üründen biyobenzerine geçiş (ve tersi), hastada antikor üretim riskini ciddi şekilde artırmaktadır. Bu nedenle, hekim onayı dahilinde bile değiştirme işleminden kaçınılması gereken bir durum olmalıdır.
-
Klinik Kanıt Eksikliği: Biyobenzerlerin birbiri yerine kullanılabilmesi için, yapıca özdeş olmanın yanı sıra, uygun düzenlenmiş geniş katılımlı klinik çalışmalarla biyolojik olarak kanıtlanmış eşitliklerinin olması gerekmektedir. Biyobenzerlerin onay süreci daha kısa olduğundan, etkinlik ve yan etkileri kısıtlı sayıda hastada denenmiştir.
-
Önerilen Yaklaşım: Eğer referans ilaç yerine biyobenzer ilaç kullanımı planlanıyorsa, bunun tedavi başlamadan önce belirlenmesi ve o şekilde kullanılması daha uygun olacaktır. Bu, hem takibi güvenli hale getirir hem de biyobenzerle ilgili veri birikimini sağlar.
5. Hekimin Rolü ve Güven Sorunu
-
Biyobenzerlerin güvenli olduğu kanıtlanmış olsa bile, referans ilaca göre daha az hastada kullanılmış olmaları ve kısıtlı klinik veri ile onay almaları, bazı doktor ve hastalarda güvensizlik durumu yaratabilmektedir.
-
Bu nedenle, ilacın değiştirilebilir ya da yerine kullanılabilir olması yetkisinin, bu konuda endişesi olmayan hekimin inisiyatifinde olması hasta sağlığı ve takibi açısından en uygun yaklaşımdır.

